ការបង្កឡើងរបស់ កោសិកាដើម pluripotent
Induced pluripotent stem cells (iPS cell/iPSC) ឬកោសិកាដើម pluripotent ណែនាំហ្សែនជាក់លាក់ចំនួនបួនដែលបណ្តាលឱ្យមាន pluripotency ចូលទៅក្នុងកោសិកា somatic ដូចជាកោសិកាស្បែកមនុស្សពេញវ័យ ដោយគ្មាន pluripotency ។ បន្ទាប់មកដោយការទាញយកប្រូតេអ៊ីន dedifferentiation-inducing ដែលផលិតពីកោសិកាចូលទៅក្នុងហ្សែនចំនួនបួន។ ដែលបណ្តាលឱ្យ dedifferentiation ត្រូវបានបញ្ចេញ ឬណែនាំ ហើយចាក់បញ្ចូលពួកវាទៅក្នុងកោសិកា somatic កោសិកាដើមដែលមាន pluripotency ដូចជាកោសិកាដើមអំប្រ៊ីយ៉ុងអាចបង្កើតបាន។ ទាំងនេះត្រូវបានគេហៅថាដើម pluripotent ដែលជម្រុញ។ ពួកវាត្រូវបានគេហៅថាកោសិកាដើម pluripotent ឬកោសិកាដើម pluripotent ។
ក្នុងឆ្នាំ 2006 ក្រុមរបស់សាស្រ្តាចារ្យ Shinya Yamanaka នៅសាកលវិទ្យាល័យ Kyoto ក្នុងប្រទេសជប៉ុនបានទទួលជោគជ័យក្នុងការបង្កើតកោសិកាដើមដែលមានភាពសម្បូរបែបដូចជាកោសិកាដើមអំប្រ៊ីយ៉ុង ដោយបញ្ចូលហ្សែនជាច្រើនចូលទៅក្នុង កោសិកា ស្បែកកណ្ដុរ។ នៅឆ្នាំបន្ទាប់ ក្នុងឆ្នាំ 2007 ក្រុមរបស់សាស្រ្តាចារ្យ Yamanaka បានទទួលជោគជ័យក្នុងការបង្កើតកោសិកាដើម pluripotent ដោយបញ្ចូលហ្សែនទៅក្នុងកោសិកាស្បែកមនុស្សពេញវ័យ។ ក្នុងការទទួលស្គាល់ការរួមចំណែករបស់គាត់ក្នុងការរកឃើញ និងបង្ហាញថាកោសិកាចាស់ទុំ និងខុសគ្នាអាចត្រូវបានបែងចែកទៅជាកោសិកាដែលមិនទាន់ពេញវ័យ និងត្រូវបានអភិវឌ្ឍទៅជាជាលិកាទាំងអស់ម្តងទៀត សាស្ត្រាចារ្យ Shinya Yamanaka រួមជាមួយសាស្រ្តាចារ្យ John Gurden បានទទួលរង្វាន់ ណូបែលផ្នែកសរីរវិទ្យា ឬវេជ្ជសាស្ត្រឆ្នាំ 2012។ បានជ្រើសរើស។ [១]
គំនិតនៃ versatility
[កែប្រែ]ក្នុងអំឡុងពេលនៃការអភិវឌ្ឍន៍ធម្មតា កោសិកាផ្លាស់ប្តូរបន្តិចម្តងៗពីស្ថានភាពដែលមិនខុសគ្នាដំបូង ដើម្បីក្លាយជាឯកទេសក្នុងមុខងារ។ កោសិកានៅក្នុងស៊ុតបង្កកំណើតគឺ totipotent ដែលមានន័យថាពួកគេអាចបង្កើតជាលិកាគ្រប់ប្រភេទ រួមទាំងរចនាសម្ព័ន្ធដែលមិនមែនជាអំប្រ៊ីយ៉ុងដូចជាសុក។ នៅពេលដែលដំណាក់កាលនៃការអភិវឌ្ឍន៍រីកចម្រើន ហើយ blastocyst ក្លាយជា blastocyst វាអាចបែងចែកទៅជាកោសិកាខាងក្នុង និងកោសិកាខាងក្រៅ។ នៅពេលនេះ កោសិកាខាងក្នុងមាន pluripotent ហើយអាចវិវត្តទៅជាកោសិកា somatic embryonic និងកោសិកាដំណុះគ្រប់ប្រភេទ។
អត្ថប្រយោជន៍នៃកោសិកាដើម pluripotent ជំរុញ
[កែប្រែ]កោសិកាដើមអំប្រ៊ីយ៉ុងដែលស្រង់ចេញពីម៉ាសកោសិកាខាងក្នុងនៃ blastocyst មានច្រើន ហើយអាចបែងចែកទៅជាកោសិកា endoderm, mesoderm និង ectoderm ។ វាត្រូវបានគេដឹងថាកោសិកាដើមអំប្រ៊ីយ៉ុងរបស់មនុស្សអាចត្រូវបានគេប្រើប្រាស់ដើម្បីព្យាបាលជំងឺ ដូចជាជំងឺផាកឃីនសុ ន របួសឆ្អឹងខ្នង និង ជំងឺទឹកនោមផ្អែម ។ ទោះជាយ៉ាងណាក៏ដោយ កោសិកាដើមអំប្រ៊ីយ៉ុងមានដែនកំណត់ដូចជាបញ្ហាសីលធម៌នៃការបំផ្លាញអំប្រ៊ីយ៉ុង និងលទ្ធភាពនៃ ការបដិសេធ នៅពេលប្តូរចូលទៅក្នុងខ្លួនរបស់អ្នកជំងឺ។ ទោះជាយ៉ាងណាក៏ដោយ កោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិត មានសារៈសំខាន់យ៉ាងខ្លាំង ដែលពួកគេបានដោះស្រាយបញ្ហាសីលធម៌នៃការស្រាវជ្រាវកោសិកាដើមអំប្រ៊ីយ៉ុងដែលមានស្រាប់ ដែលក្នុងនោះកោសិកាដើមអាចទទួលបានដោយការបំផ្លាញអំប្រ៊ីយ៉ុងដែលកំពុងលូតលាស់នៅក្នុងស៊ុតបង្កកំណើតប៉ុណ្ណោះ។ លើសពីនេះទៀត ដោយសារកោសិការាងកាយរបស់អ្នកជំងឺត្រូវបានបំប្លែងទៅជាកោសិកាដើម វាមិនមានបញ្ហាជាមួយនឹងការបដិសេធនៃប្រព័ន្ធភាពស៊ាំនោះទេ។
វិធីសាស្រ្តនៃការបង្កើតកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញ
[កែប្រែ]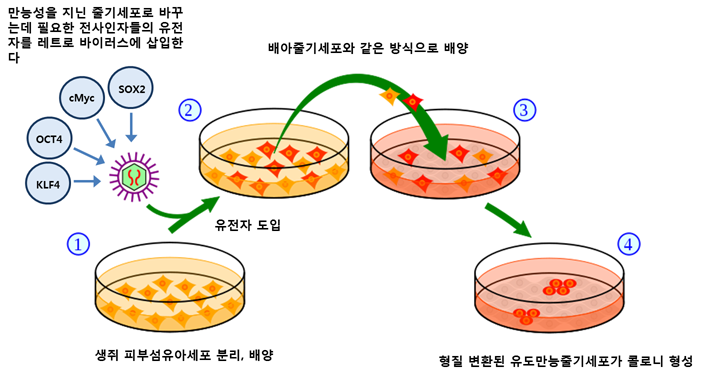
ទីមួយសាស្រ្តាចារ្យ Yamanaka ផ្អែកលើការពិតដែលថា pluripotency ត្រូវបានជំរុញនៅក្នុង កោសិកា នៅពេលដែល ការផ្ទេរនុយក្លេអ៊ែរ កោសិកា somatic ត្រូវបានអនុវត្តនៅលើ oocytes ឬនៅពេលដែលកោសិកា somatic និងកោសិកាដើមអំប្រ៊ីយ៉ុងត្រូវបានបញ្ចូលគ្នា ហ្សែនដែលដើរតួយ៉ាងសំខាន់ក្នុងការរក្សា pluripotency នៅក្នុងកោសិកាដើមអំប្រ៊ីយ៉ុងត្រូវបានកំណត់អត្តសញ្ញាណ។ ពួកគេបានសន្មត់ថាវានឹងដើរតួនាទីយ៉ាងសំខាន់ក្នុងការជំរុញឱ្យមាន pluripotency នៅក្នុងកោសិកា somatic ។ ហើយក្នុងចំណោមហ្សែនផ្សេងៗដែលដើរតួនាទីយ៉ាងសំខាន់ក្នុងការរក្សាបាននូវសារធាតុ pluripotency នៅក្នុងកោសិកាដើមអំប្រ៊ីយ៉ុង មាន 24 ហ្សែន (Ecat1, Dpp5 (Esg1), Fbx015, Nanog, ERas, Dnmt3l, Ecat8, Gdf3, Sox15, Dppa4, Dppa, Fl72, Oct4, Sox2, Rex1, Utf1, Tcl1, Dppa3, Klf4, b-cat, cMyc, Stat3, Grb2) ត្រូវបានជ្រើសរើសជាបេក្ខភាពដែលគិតថានឹងជំរុញឱ្យមានពហុភាពនៅក្នុងកោសិកា somatic ។
មុនពេលណែនាំហ្សែន 24 ជាមួយនឹងមេរោគ retrovirus ហ្សែន neomycin/lacZ ត្រូវបានបញ្ចូលដោយ ការផ្សំឡើងវិញដូចគ្នា នៅជាប់នឹង អ្នកផ្សព្វផ្សាយ Fbx15 នៅក្នុង fibroblasts ស្បែកកណ្តុរ។ Fbx15 គឺជាភ្នាក់ងារផ្សព្វផ្សាយដែលត្រូវបានធ្វើឱ្យសកម្មនៅក្នុងកោសិកាដើម pluripotent ហើយហ្សែនដែលបង្ហាញពីហ្សែន neomycin/lacZ មានភាពធន់នឹង G418 (អង់ទីប៊ីយ៉ូទិក aminoglycoside ដែលបង្ហាញជាតិពុល cytotoxicity ខ្លាំងដោយការរារាំងការសំយោគប្រូតេអ៊ីន) [២] បន្ទាប់មក ហ្សែនទាំង 24 ត្រូវបាន បំប្លែង ទៅជា fibroblasts ស្បែកកណ្ដុរ ដោយប្រើមេរោគ retrovirus ។ កោសិកាទាំងនេះត្រូវបានដាំដុះនៅលើកោសិកាចំណី STO ដែលមានប្រហែល 0.3 mg/ml នៃ G418 ។ ក្នុងចំណោមកោសិកាដែលហ្សែនត្រូវបានគេណែនាំ កោសិកាមួយចំនួនក្លាយជាកោសិកាដើមដែលមានសារធាតុ pluripotent ដែលជំរុញឱ្យមាន ហើយអាណានិគមត្រូវបានបង្កើតឡើង។
ដើម្បីស្វែងយល់ពីកត្តាសំខាន់ៗដែលជំរុញឱ្យមាន pluripotency នៅក្នុងកោសិកា somatic ក្នុងចំណោមហ្សែនទាំង 24 ហ្សែនត្រូវបានជំរុញនៅក្នុង fibroblasts ស្បែកកណ្តុរដោយការលុបហ្សែនមួយក្នុងចំណោមហ្សែនទាំង 24 ។ តាមរយៈដំណើរការនៃការវាស់ស្ទង់ការផ្លាស់ប្តូរកម្រិតនៃការបង្កើតអាណានិគមជាកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញដោយការបាត់បង់ហ្សែនមួយក្នុងចំនោម 24 ហ្សែន ប្រតិចារិកចំនួន 4 គ្រប់គ្រាន់ដើម្បីបំប្លែងកោសិកាស្បែកកណ្ដុរទៅជាកោសិកាដើម pluripotent ត្រូវបានកំណត់អត្តសញ្ញាណ។ កត្តា (តុលា 3/4, Sox2, c-Myc, Klf4) ត្រូវបានរកឃើញ។ ជាលទ្ធផល សាស្រ្តាចារ្យ Yamanaka បានទទួលជោគជ័យក្នុងការបង្កើតកោសិកាដើម pluripotent ដែលជំរុញដោយកត្តាចម្លងចំនួនបួន។ វាអាចត្រូវបានគេមើលឃើញថាកោសិកាដើម pluripotent ដែលជំរុញឱ្យបង្ហាញលក្ខណៈសម្បត្តិស្រដៀងទៅនឹងកោសិកាដើមអំប្រ៊ីយ៉ុង។ កោសិកាដើមអំប្រ៊ីយ៉ុង និងកោសិកាដើម pluripotent ដែលបង្កឡើងគឺស្រដៀងគ្នានៅក្នុង morphology ហ្សែនដែលបានសម្តែង (ប្រៀបធៀបតាមរយៈ RT-PCR និង DNA microarray ) និងគំរូ DNA methylation (ប្រៀបធៀបតាមរយៈបណ្តុំហ្សែន bisulfite) ។
ក្នុងឆ្នាំ 2006 សាស្រ្តាចារ្យ Yamanaka បានទទួលជោគជ័យក្នុងការបង្កើតកោសិកាដើម pluripotent ដោយណែនាំកត្តាចម្លងចំនួន 4 ចូលទៅក្នុង fibroblasts កណ្ដុរ។ នៅឆ្នាំបន្ទាប់គាត់ក៏បានជោគជ័យក្នុងការបង្កើតកោសិកាដើម pluripotent បំផុសគំនិតដោយមនុស្សដោយបង្កើតកត្តាចម្លងចំនួនបួនដូចគ្នានៅក្នុង fibroblasts ស្បែករបស់មនុស្សបានធ្វើ។ [៣] ក្នុងឆ្នាំដដែលនោះ ក្រុមការងាររបស់សាស្រ្តាចារ្យ James Thompson នៅសាកលវិទ្យាល័យ Wisconsin Madison បានទទួលជោគជ័យក្នុងការបង្កើតកោសិកាដើម pluripotent ពីកោសិកាស្បែកមនុស្ស ដោយណែនាំហ្សែន (Oct4, Sox2, Nanog និង Lin28) ដោយប្រើមេរោគ retrovirus ។ [៤]
ដំណើរការដែល fibroblasts កណ្ដុរវិវត្តន៍ទៅជាកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិត ឆ្លងកាត់ដំណាក់កាលជាច្រើនដែលហ្សែនត្រូវបានធ្វើឱ្យសកម្មជាបន្តបន្ទាប់។
ដំណើរការណែនាំលម្អិត
[កែប្រែ]ហ្សែន SOX2 ដើរតួនាទីយ៉ាងសំខាន់ក្នុងការរក្សាបាននូវភាពសម្បូរបែប។ SOX2 គ្រប់គ្រងកន្សោមនៃ 'DKK1' ដែលជាហ្សែនមួយផ្សេងទៀតដែលរារាំង ផ្លូវសញ្ញា Wint ហើយជាលទ្ធផលមិនត្រឹមតែរក្សា 'ពហុប៉ូត' នៃកោសិកាដើមពេញវ័យប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងធ្វើនិយ័តកម្មដំណើរការនៃភាពខុសគ្នាទៅជាកោសិកាជាក់លាក់ផងដែរ។ គោលការណ៍នៃសកម្មភាពរបស់ហ្សែន SOX2 យោងតាមប្រព័ន្ធ 'SOX2-DKK1-Wint signal' នេះគឺដូចគ្នាមិនត្រឹមតែនៅក្នុងកោសិកាដើមពេញវ័យប៉ុណ្ណោះទេ ប៉ុន្តែវាក៏មាននៅក្នុងកោសិកាដើមអំប្រ៊ីយ៉ុង និងកោសិកាដើមដែលមានសារធាតុ pluripotent ផងដែរ។ [៥]
- អាល់កាឡាំង phosphatase (AP) → អង់ទីហ្សែនអំប្រ៊ីយ៉ុងជាក់លាក់ដំណាក់កាលទី 1 (SSEA1) → ហ្សែន Nanog និង Oct4
ក្នុងចំណោមទាំងនេះ AP ចាប់ផ្តើមត្រូវបានបង្ហាញចាប់ពីថ្ងៃទី 3 បន្ទាប់ពីហ្សែនចំនួន 4 (Oct4, Sox2, Klf4, និង c-Myc) ត្រូវបានបង្ហាញនៅក្នុងកោសិកា SSEA1 ចាប់ផ្តើមបង្ហាញចាប់ពីថ្ងៃទី 9 ហើយថ្ងៃទី 4 ខែតុលា និង Nanog ចាប់ផ្តើមបង្ហាញពី ថ្ងៃទី 16. ផ្លាស់ប្តូរទៅជាកោសិកាដើម pluripotent ។ ដូច្នេះ ការបង្ហាញជាបន្តនៃហ្សែនទាំងបួនត្រូវតែកើតឡើងក្នុងរយៈពេល 12 ទៅ 16 ថ្ងៃដើម្បីបង្កើតកោសិកាដើម pluripotent ពេញលេញ។ [៦]
កត្តាភាពខុសគ្នាដែលទាក់ទង
[កែប្រែ]សុក ២
[កែប្រែ]ហ្សែន c-Myc ដើរតួក្នុងការលើកកម្ពស់ការរីកសាយ និងការផ្លាស់ប្តូរកោសិកា។ លើសពីនេះទៀតទាក់ទងទៅនឹង histone acetyltransferase វា acetylates histones ដើម្បីបន្ធូរទំនាក់ទំនងរបស់ពួកគេជាមួយ DNA ដោយហេតុនេះកាត់បន្ថយស្ថានភាពនៃការបង្ក្រាបហ្សែន។ នេះអនុញ្ញាតឱ្យខែតុលា 3/4 និង Sox2 ភ្ជាប់យ៉ាងល្អទៅនឹងទីតាំងហ្សែនជាក់លាក់ និងជំរុញការចម្លង។ [៧] ទោះជាយ៉ាងណាក៏ដោយ ហ្សែននេះគឺជាហ្សែនមហារីកមួយប្រភេទ ហើយសាស្រ្តាចារ្យ Yamanaka បានរកឃើញថា វាមិនចាំបាច់សម្រាប់ការកំណត់កោសិកាឡើងវិញនាពេលអនាគតនោះទេ។
គ-Myc
[កែប្រែ]Klf4 ត្រូវបានគេស្គាល់ថារារាំងដោយផ្ទាល់ p53 ។ [៨] p53 ត្រូវបានគេស្គាល់ថាដើម្បីទប់ស្កាត់ Nanog ក្នុងអំឡុងពេលនៃភាពខុសគ្នានៃកោសិកាដើមអំប្រ៊ីយ៉ុង។ [៩] កោសិកាដើម pluripotent ដែលត្រូវបានបង្កឡើងបង្ហាញពីប្រូតេអ៊ីន p53 តិចជាង fibroblasts ។ ដូច្នេះ ដោយការទប់ស្កាត់ p53 Klf4 នឹងធ្វើឱ្យ Nanog សកម្ម និងធ្វើឱ្យហ្សែនដែលបង្ហាញជាពិសេសនៅក្នុងកោសិកាដើមអំប្រ៊ីយ៉ុង។ [១០]
Klf4
[កែប្រែ]កត្តាចម្លងនេះ ត្រូវបានគេស្គាល់ថាជា Oct-3/4 (octamer-binding transcription) ឬ POU5F1 (POU domain, class 5, transcription factor 1) គឺជាប្រូតេអ៊ីនដែលបានអ៊ិនកូដនៅក្នុងរាងកាយដោយហ្សែន POU5F1 ។ ខែតុលា-3/4 គឺជាកត្តាចម្លង homeodomain នៃគ្រួសារ POU ។ ប្រូតេអ៊ីននេះមានសារៈសំខាន់ក្នុងការបន្តដោយខ្លួនឯងនៃកោសិកាដើមអំប្រ៊ីយ៉ុងដែលមិនមានលក្ខណៈខុសគ្នា។ ដូច្នេះ កត្តាចម្លងនេះត្រូវបានប្រើជាសញ្ញាសម្គាល់សម្រាប់ក្រឡាដែលមិនខុសគ្នា។ ការបញ្ចេញមតិនៃខែតុលា-3/4 ត្រូវតែត្រូវបានគ្រប់គ្រង។ ការបញ្ចេញមតិនៃខែតុលា-3/4 ច្រើនពេក ឬតិចពេក បណ្តាលឱ្យកោសិកាដែលមិនមានលក្ខណៈខុសគ្នា។
តុលា-៣/៤
[កែប្រែ]ក្រុមការងាររបស់សាស្រ្តាចារ្យ Shinya Yamanaka នៅសាកលវិទ្យាល័យ Kyoto ក្នុងប្រទេសជប៉ុនបានបង្កើតកោសិកាដើម pluripotent ដោយបញ្ចូលហ្សែន Oct3/4, Sox2, c-Myc និង Klf4 ចូលទៅក្នុងកោសិកាស្បែកកណ្តុរដោយប្រើ មេរោគ retrovirus ។ សាស្ត្រាចារ្យ Shinya Yamanaka បានបង្ហាញថា ការដាក់បញ្ចូលហ្សែនទាំងបួននេះ អាចបង្កើតបានគ្រប់គ្រាន់នូវ pluripotency នៅក្នុងកោសិកា somatic ។ [១១]
វិធីសាស្រ្តផលិតកោសិកាដើម pluripotent ដោយសុវត្ថិភាព
[កែប្រែ]វិធីសាស្រ្តដំបូងនៃការផលិតកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតគឺដើម្បីជំរុញឱ្យមាន pluripotent ដោយជំរុញឱ្យមានការបញ្ចេញកោសិកាដើម pluripotent ដែលត្រូវបានចាក់ដោយប្រើមេរោគដែលបណ្តាលឱ្យមានភាពខុសគ្នាកើតឡើង។ ទោះជាយ៉ាងណាក៏ដោយ នៅពេលដែលមេរោគមួយត្រូវបានប្រើប្រាស់ដើម្បីចាក់បញ្ចូលកត្តា dedifferentiation ហ្សែនដែលបានមកពីមេរោគអាចត្រូវបានបញ្ចូលទៅក្នុងកោសិកា ដែលបណ្តាលឱ្យមានការផ្លាស់ប្តូរហ្សែន ឬហានិភ័យផ្សេងទៀត។ ដូច្នេះវិធីសាស្រ្ត dedifferentiation ដោយប្រើប្រូតេអ៊ីន ឬ plasmids ដោយមិនបញ្ចូលហ្សែនបរទេសទៅក្នុងហ្សែនត្រូវបានបង្កើតឡើង។
ដើម្បីបញ្ចូល plasmid ឆ្លងចូលទៅក្នុងស្នូលនៃកោសិកាមួយ សារធាតុ nanocarrier មួយផ្សេងទៀតដែលហៅថា nanoparticle Xfect ត្រូវបានប្រើ។ តាមរយៈវិធីសាស្រ្តនេះ ខ្សែកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញអាចត្រូវបានបង្កើតឡើង។
វាក៏មានបច្ចេកវិទ្យាដើម្បីផលិតកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញពី teratoma ដែលត្រូវបានជំរុញនៅក្នុងរាងកាយដោយប្រើសត្វកណ្តុរដែលអាចរៀបចំឡើងវិញបាន។ វិធីសាស្រ្តនេះប្រើសត្វកណ្តុរដែលបង្កើតចេញពីកោសិកាដែលកន្សោមនៃហ្សែនកត្តា pluripotency ត្រូវបានគ្រប់គ្រងដោយ doxycycline ។ កោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតដែលត្រូវបានបង្កើតឡើងតាមរបៀបនេះត្រូវបានវិភាគថាមានសមត្ថភាពខុសគ្នាខ្លាំងជាងកោសិកាដើម pluripotent ដែលបង្កឡើងដែលមានស្រាប់។ វិធីសាស្ត្រដែលមានស្រាប់បានបង្ហាញពីប្រសិទ្ធភាពនៃការបែងចែកកម្រិតទាបបំផុត ដោយមានតែមួយក្នុងចំណោមពួកវាប៉ុណ្ណោះដែលក្លាយជាកោសិកាដើមដែលសម្បូរទៅដោយភាពខុសប្លែកគ្នានៅពេលដែលមានការព្យាយាមលើកោសិកាស្បែកចំនួន 1,000 ។
ការប្រើប្រាស់កោសិកាដើម pluripotent ដែលត្រូវបានជំរុញ
[កែប្រែ]ភាពជឿនលឿននៃបច្ចេកវិទ្យា dedifferentiation
[កែប្រែ]ដំបូងឡើយ វ៉ិចទ័រ retroviral ត្រូវបានប្រើដើម្បីណែនាំហ្សែនទៅក្នុងកោសិកា somatic ។ ដោយសារវ៉ិចទ័រ retroviral ត្រូវបានប្រើប្រាស់ ហ្សែនដែលបានណែនាំត្រូវបានបញ្ចូលទៅក្នុងហ្សែនដោយចៃដន្យ ដែលមានផលប៉ះពាល់នៃការបង្កមហារីក។ ក្នុងឆ្នាំ 2008 ក្រុមរបស់សាស្រ្តាចារ្យ Shinya Yamanaka បានជំរុញកោសិកាដើម pluripotent ដោយគ្មានផលប៉ះពាល់ដូចជា teratoma ដោយបញ្ចូល cDNA ដែលមានផ្ទុក Oct3/4, Sox2, c-Myc និង Klf4 ទៅក្នុងកោសិកា somatic កណ្តុរដោយគ្មានវ៉ិចទ័រមេរោគ។ [១២] លើសពីនេះ ថ្មីៗនេះ ជាជម្រើសមួយសម្រាប់ប្រព័ន្ធមេរោគ សមាសធាតុម៉ូលេគុលតូចៗ ប្រូតេអ៊ីន និងវ៉ិចទ័រមិនបញ្ចូលមិនមេរោគ (វ៉ិចទ័រ episomal) ត្រូវបានគេប្រើដើម្បីអនុញ្ញាតឱ្យហ្សែនដែលរក្សានូវសារធាតុ pluripotency ត្រូវបានផ្ទេរទៅក្នុងកោសិកាដោយមិនត្រូវបានដាក់បញ្ចូលទៅក្នុងកោសិកា។ ហ្សែននៃកោសិកា somatic ខ្ញុំកំពុងប្រើវិធីសាស្ត្រនេះ។ ទោះបីជាបច្ចេកវិទ្យា dedifferentiation ទាំងនេះកំពុងត្រូវបានបង្កើតឡើងក៏ដោយ ក៏បញ្ហាជាមួយនឹងប្រសិទ្ធភាព dedifferentiation ទាបជាងគួរឱ្យកត់សម្គាល់ និងការផលិតឡើងវិញបើប្រៀបធៀបទៅនឹងបច្ចេកទេសប្រើប្រាស់មេរោគនៅតែបន្តត្រូវបានបង្ហាញ។
នៅពេលដែលកោសិកា somatic ត្រូវបានជំរុញឱ្យក្លាយទៅជាកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញ កត្តាដែលមានហ្សែន oncogenic (c-Myc, Klf4) ត្រូវបានណែនាំដោយប្រើមេរោគ retroviruses ដូច្នេះវាមានហានិភ័យនៃការបង្កមហារីក និងការផ្លាស់ប្តូរមុខងារកោសិកា។ ទោះជាយ៉ាងណាក៏ដោយ ក្នុងឆ្នាំ 2008 ក្រុមរបស់សាស្រ្តាចារ្យ Shinya Yamanaka បានបង្កើតវិធីសាស្រ្តមួយដើម្បីបង្កើតកោសិកាដើម pluripotent ដែលបង្កឡើងដោយមិនមានហ្សែន Myc ។ [១៣] ក្រោយមក កោសិកាដើមដែលបណ្តាលឱ្យមានភាពខុសគ្នា មិនមែនជាកោសិកាស្បែកទេ ប៉ុន្តែកោសិកាដើមសរសៃប្រសាទ ដែលជាកោសិកាដើមពេញវ័យដែលបង្ហាញពីខាងក្នុងរបស់ Sox2, Myc និង Klf4 ហើយកោសិកាដើមដែលបែងចែកត្រូវបានបង្កើតឡើងដោយគ្មាន Klf4 ដែលជាហ្សែន oncogenic មួយផ្សេងទៀតក្នុងចំណោមបីដែលនៅសល់។ កត្តា។ វាត្រូវបានផលិត ហើយចាប់តាំងពីកោសិកាស្បែកបង្ហាញ C-Myc និង Klf4 ផងដែរ មានរបាយការណ៍មួយថា ភាពខុសគ្នាគឺជោគជ័យជាមួយនឹងតែ Oct4 និង Sox2 ក្នុងការសិក្សាតាមដាន។ នេះធ្វើឱ្យវាអាចបង្កើតកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញដោយមិនចាំបាច់ប្រើហ្សែន oncogenic ។
វាត្រូវបានបង្ហាញថាកត្តាតិចជាងបួន (Oct3/4, Sox2, c-Myc, និង Klf4) ត្រូវបានទាមទារដើម្បីជំរុញឱ្យមានពហុភាពនៅក្នុងប្រភេទមួយចំនួននៃកោសិកា។ ជាឧទាហរណ៍ មានតែថ្ងៃទី 4 ប៉ុណ្ណោះដែលត្រូវការដើម្បីជំរុញកោសិកាសរសៃប្រសាទនៅក្នុងសត្វកណ្តុរ។ ក្រុមរបស់សាស្រ្តាចារ្យ Seung-kwon Yoo មកពីនាយកដ្ឋានជីវបច្ចេកវិទ្យានៅសាកលវិទ្យាល័យកូរ៉េបានបង្កើតកោសិកាដើមសរសៃប្រសាទដោយបញ្ចូលហ្សែន 'Id3' ទៅក្នុងកោសិកា somatic របស់កណ្តុរ ហើយបន្ទាប់មកបញ្ចូលពួកវាទៅក្នុងកោសិកាដើម pluripotent ដោយប្រើតែហ្សែន 'Oct4' ប៉ុណ្ណោះ។ [១៤]
ដើម្បីបង្កើតកោសិកាដើម pluripotent ប្រកបដោយគុណភាព ដែលបំពេញតាមតម្រូវការទីផ្សារនានានាពេលអនាគត និងពន្លឿនការធ្វើពាណិជ្ជកម្មរបស់ពួកគេ វាជារឿងចាំបាច់ក្នុងការអភិវឌ្ឍបច្ចេកវិទ្យាឌីផេរ៉ង់ស្យែលប្រកបដោយសុវត្ថិភាព និងប្រសិទ្ធភាពខ្ពស់ជាមុនសិន។
បន្ទាប់មកនៅឆ្នាំ 2010 ក្រុមសាស្រ្តាចារ្យ Kim Hyo-soo នៃមន្ទីរពេទ្យសាកលវិទ្យាល័យជាតិសេអ៊ូល និងសាស្រ្តាចារ្យ Kwon Kwon Wook នៃវិទ្យាស្ថានស្រាវជ្រាវជីវវេជ្ជសាស្ត្រ ដែលបានទទួលជោគជ័យក្នុងការបង្កើត iPS ដោយការចាក់ប្រូតេអ៊ីនដែលចម្រាញ់ចេញពីកោសិកាដើមអំប្រ៊ីយ៉ុងចូលទៅក្នុងកោសិកា somatic ជាលើកដំបូងនៅក្នុង ពិភពលោកក្នុងឆ្នាំ 2010 ត្រូវបានបោះពុម្ភផ្សាយនៅក្នុង 'Biomaterials' ចេញផ្សាយខែឧសភា ដែលជាទិនានុប្បវត្តិសិក្សាអន្តរជាតិក្នុងវិស័យជីវវត្ថុធាតុក្នុងឆ្នាំ 2015។ តាមពិត ក្រដាសនេះចែងថាប្រសិទ្ធភាពនៃដំណើរការ dedifferentiation អាចប្រសើរឡើងយ៉ាងខ្លាំង ប្រសិនបើប្រូតេអ៊ីនចម្រាញ់ចេញពី iPS ជាជាងកោសិកាដើមអំប្រ៊ីយ៉ុងត្រូវបានចាក់ចូលទៅក្នុងកោសិកា somatic ។ នៅក្នុងបទសម្ភាសន៍ជាមួយសាស្រ្តាចារ្យ Kim សាស្រ្តាចារ្យ Kim បាននិយាយថា "អត្រានៃការបែងចែកទៅក្នុង iPS គឺលឿនជាង 10 ដងសម្រាប់កោសិកា somatic ដែលចាក់ដោយប្រូតេអ៊ីនដែលស្រង់ចេញពី iPS ជាងពេលដែលប្រូតេអ៊ីនពីកោសិកាដើមអំប្រ៊ីយ៉ុងត្រូវបានចាក់" ។ ក្រុមរបស់សាស្ត្រាចារ្យ Kim ក៏បានរកឃើញថា សារធាតុដែលបង្កើតឥទ្ធិពលនេះគឺ 'Zscan4' ក្នុងចំណោមប្រូតេអ៊ីន iPS។ សាស្ត្រាចារ្យ Kim បាននិយាយថា "ប្រូតេអ៊ីននេះមានឥទ្ធិពលធ្វើឱ្យកោសិការាងកាយមានភាពរស់រវើកឡើងវិញ ធ្វើឱ្យដំណើរការឡើងវិញនៃកោសិការាងកាយកាន់តែមានប្រសិទ្ធភាព" ។ Reprogramming សំដៅលើការផ្លាស់ប្តូរកម្មវិធីដែលកំណត់ជោគវាសនានៃក្រឡាជាក់លាក់មួយដើម្បីបែងចែកទៅជាក្រឡាមួយណា។
មានវិធីសាស្រ្តនៃការបង្កើត dedifferentiation នៅក្នុងកោសិកាដើមសរសៃប្រសាទ ដែលជាកោសិកាដើមមនុស្សពេញវ័យ ជាជាង dedifferentiating កោសិកា somatic ។ ដោយប្រើវិធីសាស្រ្តនេះ វាបង្ហាញពីប្រសិទ្ធភាពទាបបំផុត ព្រោះនៅពេលដែល dedifferentiation ត្រូវបានជំរុញនៅក្នុងកោសិកាស្បែក 1,000 ដែលជាកោសិកា somatic ទូទៅ កោសិកាមួយក្នុងចំណោមពួកវាបានក្លាយទៅជាកោសិកាដើម pluripotent។ ទោះជាយ៉ាងណាក៏ដោយ នៅពេលដែល dedifferentiation ត្រូវបានជំរុញនៅក្នុងកោសិកាដើមសរសៃប្រសាទ ដែលជាដើមពេញវ័យ។ កោសិកាពួកវាមានការរីកចម្រើនជាងកោសិកា somatic ប្រសិទ្ធភាព dedifferentiation គឺខ្ពស់ជាងប្រហែល 100 ទៅ 3000 ដង។ លើសពីនេះទៀតពេលវេលា dedifferentiation គឺប្រហែល 5 ដងលឿនជាងពេលវេលា dedifferentiation នៃកោសិកា somatic ដែលមានរយៈពេល 2 សប្តាហ៍ដែលបង្ហាញពីប្រសិទ្ធភាពខ្ពស់។ សរុបសេចក្តីមក ប្រសិនបើកោសិកាដើមពេញវ័យ ដែលជាកោសិកាដែលបង្ហាញពីកត្តា pluripotency ខាងក្នុង ត្រូវបានប្រើដើម្បីជំរុញឱ្យមានភាពខុសគ្នា នោះ dedifferentiation អាចត្រូវបានបង្កឡើង ទោះបីជាកត្តាត្រូវបានព្យាបាលខាងក្រៅក៏ដោយ។
កោសិកាដើម រួមទាំងកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតអាចជំនួសកោសិកាដែលខូចដោយជំងឺដូចជាជំងឺផាកឃីនសុន ឬជំងឺទឹកនោមផ្អែមប្រភេទទី 1 ។ ការព្យាបាលកោសិកាដើមដោយប្រើកោសិកាដើម pluripotent ជំរុញឱ្យមានការប្តូរសរីរាង្គដោយស្វ័យប្រវត្ត ដូច្នេះកាត់បន្ថយប្រូបាប៊ីលីតេនៃអ្នកជំងឺដែលបង្កើតប្រតិកម្មបដិសេធភាពស៊ាំ។ ទោះយ៉ាងណាក៏ដោយ មានបញ្ហាដែលវាអាចបណ្តាលឱ្យមានការផ្លាស់ប្តូរ ឬភាពមិនប្រក្រតីនៃហ្សែនផ្សេងទៀត។ ដូច្នេះ ការស្រាវជ្រាវតាមដានជាច្រើនគឺត្រូវការជាចាំបាច់ ដើម្បីធានាការប្រើប្រាស់ប្រកបដោយសុវត្ថិភាពចំពោះអ្នកជំងឺ។
ប្រើក្នុងការស្រាវជ្រាវវេជ្ជសាស្រ្ត
[កែប្រែ]ការដោះដូរដ៏សំខាន់ក្នុងការផលិតកោសិកា iPS នៅតែត្រូវបានសិក្សាដោយសារតែបញ្ហាដែលបានរៀបរាប់ខាងលើ។ វិធីសាស្រ្តភាគច្រើនដែលមិនពឹងផ្អែកលើរបាំងវិស្វកម្មហ្សែនគឺមិនមានប្រសិទ្ធភាពទេ ខណៈពេលដែលវិធីសាស្ត្រដែលពឹងផ្អែកលើការរួមបញ្ចូលនៃការប្តូរហ្សែនត្រូវបានព្យាយាម បើទោះបីជា បច្ចេកវិទ្យា និងវិធីសាស្រ្តជាច្រើនត្រូវបានព្យាយាម។ បច្ចុប្បន្នយើងកំពុងប្រឈមមុខនឹងបញ្ហានៃការសរសេរកម្មវិធីឡើងវិញមិនពេញលេញ និងការវិវត្តនៃដុំសាច់។ យុទ្ធសាស្ត្រទ្រង់ទ្រាយធំមួយទៀតគឺដើម្បីអនុវត្តការកំណត់លក្ខណៈប្រូតេអ៊ីននៃកោសិកា iPS ។ ការស្រាវជ្រាវបន្ថែម និងយុទ្ធសាស្ត្រថ្មីគឺត្រូវបានទាមទារ ដើម្បីផ្តល់នូវដំណោះស្រាយដ៏ល្អប្រសើរមួយ។ វិធីសាស្រ្តមួយអាចព្យាយាមទាញយកទិដ្ឋភាពវិជ្ជមាននៃយុទ្ធសាស្ត្រទាំងនេះ ហើយបញ្ចូលវាទៅក្នុងបច្ចេកទេសដ៏មានប្រសិទ្ធភាពមួយសម្រាប់ការសរសេរកម្មវិធីកោសិកាឡើងវិញសម្រាប់កោសិកា iPS ។
វិធីសាស្រ្តមួយទៀតគឺការប្រើកោសិកា iPS ដែលកើតចេញពីអ្នកជំងឺដើម្បីកំណត់អត្តសញ្ញាណថ្នាំព្យាបាលដែលអាចធ្វើត្រាប់តាម phenotype នៃជំងឺ។ ជាឧទាហរណ៍ កោសិកា iPS ដែលកើតចេញពីអ្នកជំងឺដែលរងផលប៉ះពាល់ដោយ EEC (Ectoderal Edysplasia Syndrome) ដែលហ្សែន p63 ត្រូវបានផ្លាស់ប្តូរ ត្រូវបានរៀបចំឡើងវិញដោយកត្តា reprogramming (OSKM) ដើម្បីក្លាយជាកោសិកាដើម pluripotent ដែលបន្ទាប់មកត្រូវបានបែងចែកទៅជាកោសិកាជាក់លាក់អ្នកជំងឺ។ មានអត្ថន័យនៅក្នុងនោះ វាអនុញ្ញាតឱ្យបង្កើតផលិតផលព្យាបាលកោសិកាតាមតម្រូវការ។
សមស្របសម្រាប់ phenotype ជំងឺ
តាមរយៈការទទួលបានកោសិកា somatic ការបង្កើតកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិត និងការបែងចែកពួកវានៅក្នុង vitro គំរូជំងឺអាចទទួលបានដោយសិក្សាពីដំណើរនៃជំងឺផ្សេងៗ។ បច្ចុប្បន្ននេះកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតកំពុងត្រូវបានបង្កើត និងសិក្សាពីអ្នកជំងឺដែលទទួលរងពីជំងឺផ្សេងៗ ហើយ phenotypes ដែលទាក់ទងនឹងជំងឺកំពុងត្រូវបានគេសង្កេតឃើញនៅក្នុងគំរូជំងឺទាំងនេះ។ ឧទាហរណ៍ នៅក្នុងករណីនៃកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញពីអ្នកជំងឺដែលមានសាច់ដុំឆ្អឹងខ្នង ការបាត់បង់បន្តិចម្តងៗនៃណឺរ៉ូនម៉ូទ័រត្រូវបានគេសង្កេតឃើញ។ នៅពេលដែលកោសិកាដើម pluripotent បង្កឡើងពីអ្នកជំងឺដែលមានកង្វះ alpha1-antitrypsin-ត្រូវបានបែងចែកទៅជា hepatocytes ការប្រមូលផ្តុំនៃ lipids និង glycogen កើនឡើង។ កោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតក៏ត្រូវបានគេប្រើផងដែរក្នុងការធ្វើគំរូជំងឺនៃជម្ងឺអាល់ហ្សៃមឺរ។
ការស្រាវជ្រាវតាមកោសិកាក្នុងការអភិវឌ្ឍន៍ថ្នាំ
[កែប្រែ]កោសិកាដែលមានលក្ខណៈខុសប្លែកគ្នានៅក្នុង vitro ដោយផ្អែកលើកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិត ត្រូវបានគេប្រើយ៉ាងទូលំទូលាយក្នុងការអភិវឌ្ឍថ្នាំថ្មី និងក្នុងការធ្វើតេស្តសុវត្ថិភាពនៃថ្នាំថ្មី។ ជាឧទាហរណ៍ វាត្រូវបានគេរកឃើញថា kinetin ធ្វើឱ្យធម្មតាផ្នែកខ្លះនៃការបែងចែកមិនធម្មតានៃហ្សែន IKBKAP ដែលបណ្តាលឱ្យមានភាពស្វ័យភាពក្នុងគ្រួសារ។ [១៥] លើសពីនេះទៀត beta-blockers និង ion channel blockers ក៏ត្រូវបានគេរកឃើញថាមានប្រសិទ្ធភាពក្នុងការគ្រប់គ្រង phenotype នៃ long QT syndrome ។ [១៦]
ការព្យាបាលភាពគ្មានកូន
[កែប្រែ]នៅថ្ងៃទី 8 ខែកក្កដា ឆ្នាំ 2009 ក្រុមស្រាវជ្រាវរបស់ វេជ្ជបណ្ឌិត Karim Nayenia នៅ សាកលវិទ្យាល័យ Newcastle ក្នុងចក្រភពអង់គ្លេស និង វិទ្យាស្ថាន New England Complex Systems Institute (NESCI) បានផលិត មេជីវិតឈ្មោលនៅក្នុង vitro ដំបូងបង្អស់របស់ពិភពលោកពីកោសិកាដើមអំប្រ៊ីយ៉ុងរបស់មនុស្ស។ កោសិកាដើមអំប្រ៊ីយ៉ុងអាចបែងចែកទៅជាកោសិកាប្រភេទណាក៏បាន ប៉ុន្តែនេះជាលើកដំបូងដែលពួកវាត្រូវបានដាំដុះដោយជោគជ័យទៅជាមេជីវិតឈ្មោល។ ទោះយ៉ាងណាក៏ដោយ កោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតមិនត្រូវបានប្រើទេ។ វេជ្ជបណ្ឌិត Karim Nayenia មកពីប្រទេសអ៊ីរ៉ង់ កំពុងធ្វើការស្រាវជ្រាវនៅប្រទេសអាល្លឺម៉ង់ ប៉ុន្តែនៅពេលដែលរដ្ឋាភិបាលអាល្លឺម៉ង់បានហាមឃាត់ការស្រាវជ្រាវកោសិកាដើមអំប្រ៊ីយ៉ុងរបស់មនុស្ស គាត់បានផ្លាស់ទៅសាកលវិទ្យាល័យ Newcastle ក្នុងប្រទេសអង់គ្លេសក្នុងឆ្នាំ 2006 ដើម្បីបន្តការស្រាវជ្រាវរបស់គាត់។ [១៧]
នៅថ្ងៃទី 5 ខែសីហា ឆ្នាំ 2011 ក្រុមស្រាវជ្រាវរបស់សាស្រ្តាចារ្យ Michinori Saito នៅសាកលវិទ្យាល័យ Kyoto ក្នុងប្រទេសជប៉ុនបានក្លាយជាមនុស្សដំបូងគេក្នុងពិភពលោកដែលរៀបចំកោសិកា somatic របស់កណ្តុរចូលទៅក្នុងកោសិកាដើម pluripotent បំផុសគំនិត រៀបចំពួកវាម្តងទៀតដើម្បីបង្កើតមេជីវិតឈ្មោល និងបង្កកំណើតនៅក្នុង vitro ដើម្បីផ្តល់កំណើតដល់ទារក។ សត្វកណ្ដុរ។ នៅថ្ងៃដដែលនោះវាក៏ត្រូវបានគេបង្ហាញនៅលើអ៊ីនធឺណិតកំណែ របស់ទស្សនាវដ្ដី Cell ដែរ។ វាជាលើកដំបូងនៅលើពិភពលោកដែលបង្កើតមេជីវិតឈ្មោលពីកោសិកាដើមអំប្រ៊ីយ៉ុងកណ្តុរ ដើម្បីបង្កើតមេជីវិតឈ្មោលពីកោសិកាដើម pluripotent ដែលជំរុញដោយកណ្តុរ និងសម្រេចបានជោគជ័យក្នុងការបង្កកំណើត និងកំណើតតាមរយៈមេជីវិតឈ្មោល។ [១៨]
ក្នុងឆ្នាំ 2012 ក្រុមស្រាវជ្រាវ នៅសាកលវិទ្យាល័យ Pittsburgh ក្នុងសហរដ្ឋអាមេរិកបានក្លាយជាមនុស្សដំបូងគេក្នុងពិភពលោកដែលទទួលបានជោគជ័យក្នុងការបង្កើតកោសិកាមេជីវិតឈ្មោលដោយបំប្លែងកោសិកាស្បែកពីបុរសដែលមានមុខងារបន្តពូជធម្មតាទៅជាកោសិកាដើម pluripotent បង្កឡើង។
នៅថ្ងៃទី 1 ខែឧសភា ឆ្នាំ 2014 វេជ្ជបណ្ឌិត Rayho Pera នៃវិទ្យាស្ថាន Stem Cell Biology and Regenerative Medicine នៃ សាកលវិទ្យាល័យ Stanford បានកាត់បន្ថយកោសិកាស្បែករបស់បុរសដែលមានជំងឺ azoospermia ដែលមិនមានមេជីវិតឈ្មោលដោយសារតែភាពមិនប្រក្រតីនៃក្រូម៉ូសូម Y ចូលទៅក្នុងកោសិកាដើម pluripotent ដែលបង្កឡើង ហើយចាក់ចូលទៅក្នុង ពងស្វាសរបស់សត្វកណ្ដុរ។ យើងជោគជ័យក្នុងការរីកលូតលាស់ កោសិកាមេជីវិតឈ្មោល ដែលជាកោសិកាមេជីវិតឈ្មោលដំណាក់កាលដំបូង ។ ជាលើកដំបូងនៅក្នុងពិភពលោក មេជីវិតឈ្មោលត្រូវបានផលិតចេញពីស្បែករបស់បុរស azoospermic ។ [១៩]
ដែនកំណត់
ក្នុងឆ្នាំ 2006 ក្រុមស្រាវជ្រាវរបស់ Yamanaka បានជ្រើសរើសហ្សែនចំនួន 24 ដែលអាចជំរុញឱ្យមាន pluripotency នៅក្នុងកោសិកា somatic ជាបេក្ខជន។ ក្នុងចំនោមពួកគេ ខែតុលា 3/4 និង Sox2 ត្រូវបានគេរកឃើញថាជាកត្តាសំខាន់សម្រាប់ការបង្កើតកោសិកាដើម pluripotent ហើយ Nanog ដែលត្រូវបានគេស្គាល់នៅក្នុងការសិក្សាពីមុនថាជាកត្តាចម្លងដ៏សំខាន់មួយដែលរក្សា pluripotency ត្រូវបានគេរាយការណ៍ថាមិនទាក់ទងទៅនឹងយន្តការ reprogramming ពិតប្រាកដនោះទេ។ . លើសពីនេះទៀត វាត្រូវបានគេរកឃើញថា c-Myc និង Klf4 ដើរតួនាទីយ៉ាងសំខាន់ក្នុងការបង្កើតកោសិកាដើម pluripotent ដែលត្រូវបានជំរុញ ហើយកត្តាដែលទាក់ទងនឹងដុំសាច់ទាំងពីរនេះត្រូវបានផ្សារភ្ជាប់ទៅនឹង oncogenes ផ្សេងទៀត (E-Ras, Tcl1, ß-catenin, Stat3) ។ វាត្រូវបានរាយការណ៍ថាវាមិនអាចទៅរួចទេក្នុងការជំនួសវា។ ក្រោយមកក្នុងឆ្នាំ 2007 ក្រុមស្រាវជ្រាវ Thomson បានធ្វើការពិសោធន៍ដោយប្រើបន្សំផ្សេងគ្នា (Oct4, Sox2, Nanog, Lin28) ជាងការពិសោធន៍របស់ក្រុមស្រាវជ្រាវ Yamanaka ជាលទ្ធផលកត្តា Nanog ដែលត្រូវបានគេដឹងថាមិនទាក់ទងទៅនឹងយន្តការ reprogramming នៅក្នុងការសិក្សាពីមុន វាត្រូវបានគេរកឃើញថាវារួមចំណែកដល់ការបង្កើនប្រសិទ្ធភាពនៃ reprogramming និងបង្កើនអត្រារស់រានមានជីវិតដំបូងនៃកោសិកា reprogrammed ហើយវាត្រូវបានគេរាយការណ៍ថា Lin28 ក៏ចូលរួមក្នុងការបង្កើតកោសិកាដើម pluripotent ផងដែរ។ ទោះបីជាការសិក្សាជាច្រើនបានព្យាយាមវិភាគយន្តការជាមូលដ្ឋាននៃកោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិត និងធ្វើអោយប្រសើរឡើងនូវភាពពេញលេញនៃបច្ចេកវិទ្យាក៏ដោយ កោសិកាដើម pluripotent ដែលត្រូវបានបំផុសគំនិតនៅតែមានដែនកំណត់មួយចំនួននៅក្នុងការអនុវត្តផ្នែកព្យាបាល។ ការប្រើប្រាស់មេរោគសម្រាប់ការណែនាំហ្សែន (iPSCs) និងដុំសាច់នៃកត្តាដូចជា c-Myc និង Klf4 ត្រូវបានចាត់ទុកថាជាដែនកំណត់តំណាងនៃកោសិកាដើម pluripotent ដែលបង្កឡើង។ [២០]
លេខយោង
[កែប្រែ]- ↑ http://www.nobelprize.org/nobel_prizes/medicine/laureates/2012/#
- ↑ https://terms.naver.com/entry.nhn?cid=561&docId=435663&mobile&categoryId=561
- ↑ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K et al (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131:861-872
- ↑ Junying Yu, Maxim A. Vodyanik, Kim Sumuga-Otto, Jessica Antosiewicz-Bourget, Jeniffer L. Frane, Shulan Tian, Jeff Nie, Gurdrun A. Jonsdottir, Victor Ruotti, Ron Stewart, Igor I. Slukvin, and James A. Thomson (2007). Induced Pluripotent stem cell lines derived from human somatic cells.. Science 21 December 2007: 1917-1920
- ↑ http://app.yonhapnews.co.kr/YNA/Basic/article/new_search/YIBW_showSearchArticle_New.aspx?searchpart=article&searchtext=%EC%84%B1%EC%B2%B4%EC%A4%84%EA%B8%B0%EC%84%B8%ED%8F%AC+%EB%B6%84%ED%99%94%EC%A1%B0%EC%A0%88+%EC%9C%A0%EC%A0%84%EC%9E%90%EF%BF%BD%EC%9B%90%EB%A6%AC+%EB%B0%9D%ED%98%80&contents_id=AKR20111110102500017[តំណភ្ជាប់ខូច]ទំព័រគំរូ:깨진 링크
- ↑ http://bloodjournal.hematologylibrary.org/content/114/27.abstract.pdf
- ↑ Fernandez, P.C., Frank, S.R., Wang, L., Schroeder, M., Liu, S., Greene,J., Cocito, A. and Amati, B. (2003). Genomic targets of the human c-Myc protein. Genes Dev. 17, 1115-1129
- ↑ Rowland, B.D., Bernards, R., and Peeper, D.S. (2005). The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene. Nat. Cell Biol. 7, 1074-1082
- ↑ Lin, T., Chao, C., Saito, S., Mazur, S.J., Murphy, M.E., Appella, E., and Xu, Y. (2004) p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression. Nat. Cell Biol. 7, 165-171. Published Online December 26, 2004. 10.1038/ncb1211
- ↑ Takahashi K, Yamanaka S(2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126: 663-676
- ↑ Takahashi K, Yamanaka S(2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126: 663-676
- ↑ http://www.sciencemag.org/content/322/5903/949.abstract
- ↑ Nakagawa, Masato Koyanagi, Michiyo Tanabe, Kazutoshi Takahashi, Kazutoshi Ichisaka, Tomoko Aoi, Takashi Okita, Keisuke Mochiduki, Yuji Takizawa, Nanako Yamanaka, Shinya(2008). Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature biotechnology / v.26 no.1, 2008년, pp.101-106
- ↑ http://www.hellodd.com/kr/dd_news/article_view.asp?mark=36443[តំណភ្ជាប់ខូច]ទំព័រគំរូ:깨진 링크
- ↑ Lee G, Papapetrou EP, Kim H, Chambers SM, Tomishima MJ, Fansano CA, et al (2009). Modeling pathogenesis and treatment of familial dysautonomia using patient-specific iPSCs. Nature 461:402-406
- ↑ Itzhaki I, Maizel L, Huber I, Zwi-Dantsis L, Caspi O, Winterstern A et al (2011). Modelling the long QT syndrome with induced pluripotent stem cells. Nature 461
- ↑ 배아줄기세포로 정자 만들었다, 경향신문, 2009-07-08
- ↑ 쥐의 줄기세포로 만든 정자 수정 새끼쥐 낳았다, 한국일보, 2011-08-05
- ↑ 美, 무정자증 남성 피부세포로 정자 만들어…`깜짝`, 매일경제, 2014-05-05
- ↑ "김영진. "유도만능줄기세포의 현재와 전망." 국내석사학위논문 고려대학교 의학전문대학원, 2014. 서울".
សូមមើលផងដែរ
[កែប្រែ]- Shinya Yamanaka
- រង្វាន់ណូបែលផ្នែកសរីរវិទ្យា ឬវេជ្ជសាស្ត្រ
- សទិសន័យ
- កោសិកាដើម pluripotent
- កោសិកាដើម pluripotent សិប្បនិម្មិត
- កោសិកា IPS
